O que é uma onda?
Existem muitos tipos de ondas na natureza [1]. Por exemplo:
- Ondas sonoras, que são os diversos tipos de sons (audíveis ou não para os seres humanos).
- Ondas eletromagnéticas, que são os diversos tipos de luzes (visíveis ou não para os seres humanos).
- Ondas na água, como no caso de lagos e mares.
Essas ondas, por mais diferentes que sejam, têm algo em comum. Esse “algo em comum” é justamente o que define todos esses fenômenos aparentemente tão díspares como ondas.
Mas o que é uma onda? A etimologia da palavra indica que “onda” vem do latim “unda”, que significa “água em movimento; ar em movimento; agitação de uma multidão”. A própria etimologia indica que o conceito de onda tem algo a ver com movimento, com a ruptura de um equilíbrio.
Assim, toda onda é caracterizada pela OS CI LA ÇÃO de alguma variável física [1]. No caso das ondas sonoras e das ondas na água, a variável que oscila é a pressão [1]. No caso das ondas eletromagnéticas, as variáveis que oscilam são os campos elétrico e magnético [1]. Dizer que há uma variável física que oscila significa dizer que o valor desta variável aumenta e diminui periodicamente [2]. Em outro texto desta série, falaremos mais sobre a natureza dessa oscilação.
Para que possa haver oscilação de pressão, algumas condições precisam ser satisfeitas. Primeiro, precisa haver matéria. Segundo, a matéria precisa ser elástica. Terceiro, precisa haver uma perturbação na matéria.
Matéria
A primeira condição que precisa ser satisfeita para haver oscilação de pressão é a existência de matéria.
Mas o que é matéria? Não há definição consensual na Física, mas, na Mecânica Clássica, a matéria é definida como qualquer corpo, substância ou partícula que possui massa inercial [2, 3]. Esta forma de entender a matéria decorre da Física de Isaac Newton do século XVII.
A massa é uma propriedade quantitativa e mensurável da matéria. É uma propriedade que determina a inércia de um corpo, de uma substância ou de uma partícula [2, 3]. Quanto mais massivo for um corpo, uma substância ou uma partícula, maior a força necessária para colocá-lo em movimento (ou maior a resistência que precisa ser oferecida para impedir o movimento e colocá-lo em repouso). Esta é a definição clássica de massa, estabelecida por Newton. Assim, matéria e massa não são termos sinônimos e esta é uma distinção cara à Física [2, 3].
Um conceito essencial ao se falar de matéria é o conceito de átomo, que é o principal elemento de composição da matéria. Foi ainda na Grécia Antiga que surgiu a ideia de átomo. Leucipo de Mileto e Demócrito de Abdera defendiam que a matéria era formada por partículas muito pequenas e indivisíveis [4]. A própria palavra “átomo” nasceu nesta época (século V a. C.): o prefixo “a-“ significa “privação, negação” e o elemento pospositivo “-tome” significa “corte, separação”. Leucipo e Demócrito também concebiam a existência do vácuo [4]. Epicuro de Samos (no século IV a. C.) e o poeta Tito Lucrécio (no século I a. C.) também defendiam o atomismo. Lucrécio dedicou versos ao atomismo em sua obra “de Rerum Natura “[4].
A ideia do atomismo ficou esquecida durante séculos, tendo sido retomada na Europa, no século XVII, pela influência da tradução da obra de Aristóteles e da descoberta de “de Rerum Natura” de Lucrécio [4]. (Aristóteles não acreditava na ideia de átomo, mas na ideia de que a matéria era formada por combinações de água, ar, terra, fogo e que o espaço era formado por éter) [4]. Isaac Newton teve papel importante na retomada do atomismo [4]. Diversos fatos empíricos sugeriam a existência de átomos, como os processos físicos de condensação e evaporação de substâncias e a catalogação de diversos gases [4].
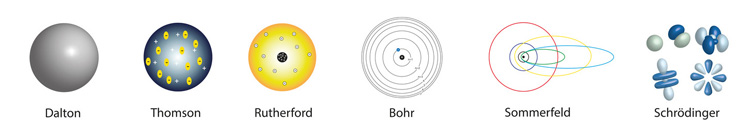
No início do século XIX, John Dalton realizou experimentos físicos com gases, que o fez propor uma hipótese sobre a constituição da matéria [4]. Ele apresentou o primeiro modelo atômico, retomando o atomismo grego: a matéria seria composta por partículas muito pequenas, maciças e indivisíveis (veja representação gráfica do modelo aqui) [4]. Os átomos de um elemento químico seriam todos idênticos, assim como elementos químicos diferentes seriam compostos por átomos diferentes [2, 4]. Dalton apresentou seus achados e suposições no livro “A new system of Chemical Philosophy”, publicado em 1808. Ele recebeu a Medalha Real inglesa em 1826 por seus estudos. (Out of topic: Dalton não enxergava cores e foi ele quem primeiro descreveu este distúrbio visual. Por isso, essa condição ficou conhecida como “daltonismo” [2]).
Entretanto, a natureza submicroscópica do átomo era o grande obstáculo para a aceitação do atomismo. Essa resistência ao atomismo persistiu até a metade do século XIX [4]. O atomismo foi de fato aceito apenas com as experiências de Lorenzo Avogadro, que demonstrou que gases diferentes contêm o mesmo número de moléculas desde que tenham o mesmo volume e estejam nas mesmas condições de temperatura e pressão [2, 4]. Em 1860, pela primeira vez, o átomo é consensualmente definido: é a menor massa que pode se combinar [4].
No final do século XIX, em 1897, Joseph Thomson realizou experiências com descargas elétricas em gases, as quais o levaram a concluir que a eletricidade era constituída por feixes de carga negativa [4]. Ele foi o primeiro a conceber a existência de partículas menores do que os átomos, que chamou de “corpúsculos” [4]. Mais tarde, os corpúsculos receberam nova nomenclatura: elétrons. Foi ele quem criou o segundo modelo atômico: uma massa arredondada, de carga positiva, com elétrons incrustados (veja representação gráfica do modelo aqui) [4]. Ele anunciou seus achados no artigo “Cathode rays” na revista Philosophical Magazine. Ele ganhou o Prêmio Nobel de Física de 1906 devido à descoberta do elétron.
No início do século XX, em 1911, Ernest Rutherford, aluno de Thomson, realiza experiências com feixes de radiação em folhas de ouro. Ele percebeu que boa parte dos feixes atravessava o ouro, o que o levou a concluir que o átomo era, em grande parte, formado por vazio. Entretanto, alguns feixes retrocediam ao incidirem sobre o átomo, o que o levou a concluir que havia uma região de aglomeração no interior do átomo. Assim, ele concebeu a existência dos prótons, com carga positiva [4]. Ele elaborou o terceiro modelo atômico: prótons concentrados no núcleo, com elétrons girando ao redor, como um pequeno sistema solar (veja representação gráfica do modelo aqui) [4]. Ele publicou seus achados no artigo “The scattering of alpha and beta particles by matter and the structure of the atom” na revista Philosophical Magazine. Rutherford não ganhou o Prêmio Nobel de Física por esta descoberta (talvez porque já tivesse ganhado o Prêmio Nobel de Química em 1908 devido a estudos sobre radiação).
Em 1913, Niels Bohr, aluno de Rutherford, elabora o quarto modelo atômico. Os elétrons apresentariam energia constante, o que possibilitaria que estivessem em órbita circular e bem definidas em torno do núcleo [2, 4]. Devido à energia constante, os elétrons não desabariam sobre o núcleo (veja representação gráfica do modelo aqui) [4]. Este modelo funciona adequadamente apenas para o átomo de hidrogênio. Ele publicou seus achados em uma série de três artigos “On the constitution of atoms and molecules (Part I, Part II, Part III)” na revista Philosophical Magazine. Bohr ganhou o Prêmio Nobel de Física em 1922 pela descrição da órbita dos elétrons.
Em 1916, Arnold Sommerfeld elabora o quinto modelo atômico. Os elétrons estariam em órbita elíptica, e não circular, em torno do núcleo (veja representação gráfica do modelo aqui) [4]. Cada órbita seria descrita por números quânticos específicos. Ele publicou seus achados no artigo “Zur Quantentheorie der Spektrallinie” na revista Annalen der Physik. Sommerfeld foi indicado 84 vezes para o Prêmio Nobel de Física.
Em 1926, Erwin Schrödinger propõe o modelo atual. A noção de órbita foi abandonada e passou-se a adotar a noção de orbital. Assim, um elétron apresenta probabilidade maior ou menor de estar em certa região do espaço atômico, sendo o orbital a região em que há 99% de chance de haver um dado elétron [4]. O comportamento do elétron passou a ser visto como uma partícula que apresenta comportamento de onda [2]. Ele publicou seus achados no artigo “Quantisierung als Eigenwert problem” na revista Annalen der Physik. Em 1928, Paul Dirac apresentou uma equação que descrevia o comportamento ondulatório dos elétrons, além de ter previsto a existência de antimatéria [2]. Ele publicou seus achados no artigo “The quantum theory of the electron” nos Proceedings of the Royal Society of London. Schrödinger e Dirac dividiram o Prêmio Nobel de Física em 1933.
Finalmente, em 1932, James Chadwick, também aluno de Rutherford, descreve o nêutron [2, 4]. Através de experimentos, ele percebeu que havia partículas subatômicas que eram capazes de penetrar os mais variados elementos, sem serem repelidas. Por não serem repelidas, concluiu que essas partículas tinham carga elétrica nula, a qual deu o nome de nêutron [2 ,4]. Ele apresentou seus achados no artigo “Possible existence of a neutron” na revista Nature. Chadwick ganhou o Prêmio Nobel de Física em 1935 pela descoberta.
Este breve apanhado teve a intenção de mostrar que a história do átomo vem de longa data. Além disso, pesquisadores que efetivamente contribuíram para esclarecer a constituição e o funcionamento atômico foram reconhecidos e premiados. A figura abaixo exemplifica a evolução dos modelos atômicos. Se hoje em dia é de conhecimento corrente que os átomos são formados por prótons, elétrons e nêutrons, esse conhecimento foi construído pouco a pouco.
Prótons, elétrons e nêutrons são formas de matéria, porque possuem massa inercial. Também existem os antiprótons e os pósitrons, partículas com a mesma massa dos prótons e dos elétrons, respectivamente, mas com carga elétrica contrária. Também existe o antinêutron que á uma partícula de mesma massa inercial do nêutron e também com carga elétrica nula. Os antiprótons, pósitrons e antinêutrons são formas de antimatéria. (A antimatéria não existe de forma espontânea no universo. Ela é encontrada apenas de forma artificial [2]). Todas essas partículas são divisíveis em outras partículas menores [2]. A Física de Partículas ainda está em busca de quais seriam as partículas fundamentais, ou seja, partículas que não podem mais ser divididas [2]. Portanto, o átomo, no sentido estrito de significação, não é mais o elemento indivisível.
A matéria é fundamental para a produção de ondas sonoras, porque serão justamente as partículas que possuem massa que, ao oscilarem em torno de suas posições de equilíbrio, irão produzir variações de pressão [1]. Ou seja, no vácuo, que é a ausência de matéria, não há possibilidade de haver ondas sonoras. Mas, por outro lado, é possível haver ondas eletromagnéticas e gravitacionais, porque as variações dos campos elétrico e magnético e do campo gravitacional não dependem da existência de matéria. As ondas eletromagnéticas e as gravitacionais são os únicos tipos de ondas que se propagam na ausência de meio material [2].
Embora a matéria seja fundamental para a produção de som, o som em si não é uma forma de matéria. O som é uma forma de energia.
No próximo texto, falaremos sobre a segunda condição que precisa ser satisfeita para haver oscilação de pressão: elasticidade.
Referências
[1] Okuno, E.; Caldas, I. L. & Chow, C. (1982). Ondas. In: Física para ciências biológicas e biomédicas (pp. 206-221). São Paulo: Harper & Row do Brasil.
[2] Roditi, Y. (2005). Dicionário Houaiss de Física. Rio de Janeiro: Objetiva.
[3] Petrônio, R. (2014). Epistemologia da matéria: algumas reflexões sobre sua representação e estatuto ontológico. Revista Brasileira de Ensino de Física, 36 (4). [Artigo disponível aqui].
[4] Antunes, M. C. P. M. M. (2012). Revisão da literatura. In: A história do átomo no ensino da Física e da Química: um estudo com manuais escolares do 9º e 10º anos de escolaridade e seus autores (pp. 17-59). Dissertação de Mestrado. Universidade do Minho (Portugal). [Dissertação disponível aqui].