Potencial de ação muscular
No texto anterior desta série, foi discutido que os aparelhos de eletroterapia não invasiva agem despolarizando as fibras neurais, o que dispara potenciais de ação. Os potenciais de ação, por sua vez, podem induzir contrações musculares, caso a intensidade do aparelho seja suficiente.
Neste texto, vamos explorar a fisiologia da contração muscular e da junção neuromuscular. O mecanismo básico da contração é o deslizamento dos filamentos de actina sobre os de miosina, mediado por íons de cálcio. Vamos falar especificamente das fibras musculares estriadas esqueléticas, que são a grande maioria dos músculos envolvidos na produção da fala. A razão de esses músculos serem chamados de “estriados” ficará clara logo mais no texto. A razão de serem chamados de “esqueléticos” deve-se ao fato desses músculos se unirem aos ossos do esqueleto através de tendões.
Do macroscópico ao microscópico
O corpo humano possui cerca de 600 músculos. Os músculos importantes para a fala estão localizados na cabeça, no pescoço e no tronco. Geralmente são músculos pequenos e com rica inervação, o que confere maior sensibilidade e precisão aos movimentos.
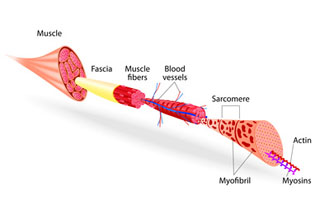
Do músculo macroscópico até os filamentos proteicos da célula muscular, há uma organização hierárquica. O músculo como um todo é formado por diversos feixes musculares e é envolvido por uma camada de tecido conjuntivo (chamada de epimísio). Os feixes musculares, por sua vez, são formados por células musculares e são envolvidos por outra camada de tecido conjuntivo (chamada de perimísio). As células musculares são também revestidas por tecido conjuntivo (chamado de endomísio). Veja aqui duas imagens histológicas que ilustram muito bem as subdivisões sucessivas do músculo.
A célula muscular
A célula muscular é uma célula típica no sentido de que apresenta as duas divisões principais (citoplasma e núcleo) e também apresenta as organelas típicas das células animais. Por outro lado, ela apresenta uma particularidade que a diferencia muito das demais células do organismo: as miofibrilas, que são filamentos proteicos capazes de contração e relaxamento [1]. A célula muscular tem até nome especial: é chamada de “fibra muscular”. Ela realmente faz jus ao nome “fibra” (no sentido de ser uma estrutura alongada e delgada), porque se prolonga por toda a extensão do músculo. Além disso, toda fibra muscular é inervada por uma e apenas uma terminação nervosa, a qual se insere no ponto médio da fibra [1]. É exatamente no ponto de inserção das terminações nervosas no músculo que devem ser fixados os eletrodos dos aparelhos de eletroterapia não invasiva.
A fibra muscular estriada esquelética é chamada de “estriada”, porque, em corte longitudinal no microscópio óptico, são visualizadas listras [1], como muito bem demonstra esta imagem histológica. As estrias são originadas pelas bandas claras e escuras.
As bandas claras são formadas por filamentos de actina [1]. São também chamadas de “bandas I”. A letra “I” vem de isotrópico (“iso-” = o mesmo, “tropo-” = volta, “-ico” = relativo), que significa que a luz emitida pelo microscópio volta relativamente a mesma depois de incidir nesta banda, ou seja, a luz do microscópio é refletida de maneira uniforme.
As bandas escuras são formadas por filamentos de actina e miosina [1]. São também chamadas de “bandas A”. A letra “A” vem de anisotrópico (“a-” = não), que significa que a luz emitida pelo microscópio não volta relativamente a mesma depois de incidir nesta banda, ou seja, a luz do microscópio é refletida de maneira irregular.
Dando suporte para os filamentos de actina e miosina, estão os discos Z, que são linhas escuras visualizadas no microscópio [1]. A letra “Z” vem de “Zwischenscheibe”, uma simpática palavra em alemão que quer dizer “disco intercalado”. Estes discos são formados por outras proteínas. Eles cruzam a miofibrila em toda sua extensão e unem uma miofibrila à outra [1]. É por isso que as miofibrilas não ficam soltas no interior da fibra muscular.
Veja aqui uma imagem histológica que ilustra bem as bandas A e os discos Z.
Veja aqui um desenho que ilustra as bandas I, as bandas A e os discos Z.
A região entre dois discos Z é chamada de sarcômero (veja aqui um desenho). É exatamente o sarcômero que irá encurtar na contração muscular e irá alongar no relaxamento muscular [1].
A organização dos filamentos de actina e de miosina em sarcômeros sucessivos ao longo da fibra muscular é chamada de miofibrila (“mio” = músculo e “fibrila” = diminutivo de “fibra”). Ou seja, as miofibrilas são fibras muito pequenas que compõem a fibra muscular. Cada fibra muscular possui muitas miofibrilas: o número varia entre centenas e milhares, dependendo do tamanho da célula [1].
Miosina e actina são moléculas de proteína.
Filamentos de miosina
Cada filamento é formado por cerca de 200 moléculas de miosina [1]. Veja o item C neste desenho.
Cada molécula de miosina é composta por seis cadeias polipeptídicas [1]. As duas cadeias mais pesadas se entrelaçam como dupla hélice e formam a cauda da molécula. As quatro cadeias mais leves se entrelaçam de duas em duas e formam as cabeças da molécula. Veja o item B neste desenho.
No filamento de moléculas de miosina, as diversas caudas se unem para formar o corpo do filamento. Parte das caudas (chamadas “braços”) e as cabeças das moléculas pendem para fora do corpo: são as pontes cruzadas. As pontes cruzadas são flexíveis em dois pontos: na articulação dos braços com o corpo e na articulação das cabeças com o braço. Os braços auxiliam no movimento das cabeças: para longe e para perto do corpo. São as cabeças dos filamentos de miosina que participam efetivamente do mecanismo de contração muscular [1].
Antes de a contração iniciar, as cabeças das pontes cruzadas ligam-se ao ATP. A atividade da enzima ATPase quebra o ATP, mas segura os produtos (ADP e fosfato) na cabeça da molécula de miosina até a ligação com o sítio ativo da molécula de actina G [1].
Filamentos de actina
É composto por actina e também por tropomiosina e troponina.
O suporte principal são dois filamentos de actina F entrelaçadas. Cada filamento de actina F é composto por 13 moléculas de actina G. Ligada a cada molécula de actina G está uma molécula de ADP. As moléculas de ADP são os sítios de ativação dos filamentos de actina, com os quais as pontes cruzadas dos filamentos de miosina irão ligar [1]. As bases dos filamentos de actina estão inseridas nos discos Z, enquanto as terminações protruem para os dois sentidos e ficam entre as moléculas de miosina [1].
As moléculas de tropomiosina estão entrelaçadas com os filamentos de actina F [1]. A tropomiosina fica sobreposta às moléculas de ADP para impedir a interação entre os filamentos de actina e de miosina durante o repouso. Um filamento puro de actina, sem a presença de tropomiosina ou troponina, liga-se instantaneamente nas cabeças do filamento de miosina [1]. Cada molécula de tropomiosina cobre cerca de sete sítios de ADP.
A troponina está ligada ao final de cada molécula de tropomiosina. A molécula de troponina é formada por três subunidades: a troponina I tem afinidade com a actina, a troponina T tem afinidade com tropomiosina e a troponina C com íons de cálcio. As subunidades I e T ajudam a dar estabilidade ao complexo actina-troponina-tropomiosina [1].
Veja aqui um desenho do filamento composto por actina, tropomiosina e troponina.
Junção neuromuscular
As fibras musculares esqueléticas são inervadas por fibras neurais grandes e mielinizadas, que se originam no tronco encefálico (no caso dos nervos cranianos) e no corno anterior da medula espinhal (no caso dos outros nervos). Cada fibra neural se ramifica em sua porção final, inervando de três até várias centenas de fibras musculares. A fibra neural e as fibras musculares a ela interligadas formam uma unidade motora [2]. O número de fibras musculares por fibra neural depende da função do músculo. Músculos pequenos (como os da laringe), cujo controle deve ser fino, têm poucas fibras musculares em cada unidade motora. Músculos grandes, que não requerem controle fino, têm centenas de fibras musculares para cada fibra neural. No geral, a média é de 100 fibras musculares para cada fibra neural [2].
A terminação da fibra neural se acopla à fibra muscular no ponto médio da fibra. É a junção neuromuscular. Veja aqui uma imagem histológica da junção. A partir do ponto médio da fibra muscular, o potencial de ação trafega para os dois sentidos. Há apenas uma junção neuromuscular por fibra muscular [2].
A terminação nervosa empurra a fibra muscular, mas permanece no lado externo da sua membrana. Esta é a placa motora terminal [2]. A região de invaginação na membrana é chamada de vala sináptica. Na parte inferior da vala, há numerosas pregas na membrana da fibra muscular (são as fendas subneurais), as quais aumentam a área de transmissão da sinapse [2].
Veja aqui um desenho da placa motora terminal.
Quando um impulso nervoso atinge a junção neuromuscular, cerca de 125 vesículas se fundem com a membrana neural, liberando acetilcolina na fenda sináptica [2]. A concentração de moléculas de acetilcolina por vesícula chega a 10.000. A membrana da fibra muscular possui receptores de acetilcolina em suas pregas subneurais. Esta sequência de eventos leva em torno de 10 ms [2].
Os canais proteicos de acetilcolina apresentam cinco subunidades: duas alfas, uma beta, um delta e uma gama (veja aqui um desenho). O canal permanece fechado até que duas moléculas de acetilcolina se liguem às duas subunidades alfa [2]. Isso causa uma mudança conformacional que abre o canal. O canal é carregado negativamente e é grande o suficiente para também permitir a entrada de íons positivos como sódio, potássio e cálcio. Os íons que mais entram são os íons de sódio, gerando uma mudança local no potencial de membrana da fibra muscular [2]. Inicia-se então o potencial de ação na membrana da fibra muscular.
Até que haja acetilcolina no espaço sináptico, há estimulação dos receptores de acetilcolina nas pregas subneurais da fibra muscular. Mas a acetilcolina em alguns milissegundos é destruída pela enzima acetilcolinesterase, presente na vala sináptica [2]. Milissegundos são suficientes para excitar a fibra muscular.
Existem algumas diferenças entre o potencial de ação da fibra neural e da muscular [2]. Na fibra neural, os eventos são mais rápidos. O potencial de ação dura até 5 ms na fibra muscular e até 1 ms na fibra neural. Na fibra muscular, a velocidade de condução do impulso é de cerca de 5 m/s, enquanto é de 100 m/s em fibras neurais mielinizadas.
Túbulos transversos e retículo sarcoplasmático da fibra muscular
Para que o potencial de ação origine de fato a contração muscular, ele precisa ser transmitido para o interior da fibra muscular. Isso é conseguido graças aos túbulos transversos [2]. Veja aqui um desenho: os túbulos transversos são representados em amarelo. Os túbulos transversos iniciam na membrana celular e cruzam toda a célula até o outro lado da membrana, ou seja, são prolongamentos internos da membrana da fibra muscular [2]. Os túbulos transversos se comunicam com o meio extracelular e contém fluido extracelular em seu lúmen. São chamados de “tranversos”, porque se posicionam transversalmente às miofibrilas. Quando um potencial de ação se propaga pela membrana da fibra muscular, ele também se propaga pelos túbulos transversos até o interior da fibra muscular.
Os túbulos transversos se comunicam com o retículo sarcoplasmático. Veja aqui um desenho: o retículo sarcoplasmático é representado em verde. Assim, os potenciais de ação que trafegam pelos túbulos transversos, também chegam ao retículo sarcoplasmático. Ocorre então abertura dos canais de cálcio do retículo e a liberação de íons de cálcio [2]. Os canais permanecem abertos por alguns milissegundos. As paredes do retículo sarcoplasmático possuem bombas de cálcio que são continuamente ativas. É esta bomba que remove os íons de cálcio das miofibrilas e cessa a contração muscular [2].
Mecanismo molecular da contração muscular
Agora podemos elencar a sequência de eventos que desencadeia a contração da fibra muscular estriada esquelética [1, 2].
O potencial de ação se propaga por um motoneurônio, chegando até a terminação nervosa. Vesículas com acetilcolina são liberadas na fenda sináptica da placa motora terminal. A acetilcolina entra nos seus respectivos canais proteicos da fibra muscular, permitindo também a entrada de íons de sódio, os quais iniciam o potencial de ação na fibra muscular. O potencial de ação despolariza a membrana da fibra muscular e também trafega para o interior da célula pelos túbulos transversos.
A propagação do potencial de ação no interior da fibra muscular faz o retículo sarcoplasmático liberar íons de cálcio, os quais se ligam à troponina C. Essa ligação provoca uma mudança conformacional no complexo actina-troponina-tropomiosina, arrastando a tropomiosina e descobrindo os sítios de ativação das moléculas de actina G.
Quando são descobertos os sítios de ativação, as pontes cruzadas das moléculas de miosina se ligam instantaneamente a eles. Essa ligação também provoca uma mudança conformacional na posição da cabeça das moléculas de miosina, fazendo-a se inclinar em direção ao braço. Neste momento, o ADP e o fosfato que estavam armazenados na cabeça da molécula de miosina são liberados. É exatamente essa mudança conformacional na posição das cabeças e a energia liberada que fornecem a força necessária para arrastar a molécula de actina G.
A cabeça da molécula de miosina logo recebe outra molécula de ATP. Essa nova ligação de ATP separa a cabeça da molécula de miosina do sítio de ativação da molécula de actina G. A enzima ATPase quebra a molécula de ATP em ADP e fosfato, o que faz a cabeça da miosina voltar para sua posição habitual. Na posição habitual e possuindo novamente ADP e fosfato, a cabeça da molécula de miosina se combina com o sítio de ativação de outra molécula de actina G. A cabeça se inclina novamente, arrastando ainda mais o filamento de actina F.
Assim, são as cabeças das pontes cruzadas dos filamentos de miosina que literalmente puxam, molécula a molécula, o filamento de actina F em direção ao centro do filamento de miosina. Esta é a contração muscular. Quanto maior o número de pontes cruzadas em contato com as moléculas de actina G, maior a força da contração.
Veja no final desta página uma animação com o movimento das pontes cruzadas durante a contração muscular.
Como os filamentos de miosina progressivamente puxam os filamentos de actina, os discos Z ficam próximos aos filamentos de miosina. O sarcômero é encurtado. Se a contração for máxima, os filamentos de actina derivados de um disco Z chegam a se sobrepor aos filamentos de actina do próximo disco Z. É por isso que “músculo contraído” e “músculo encurtado” são expressões sinônimas.
Quando não há carga, a contração muscular é muito rápida: 100 ms são suficientes para a contração total. Quando há carga, a velocidade de contração é inversamente proporcional à massa da carga.
Quando o potencial de ação acaba, os íons de cálcio voltam ao retículo sarcoplasmático devido às bombas. A remoção dos íons de cálcio cessa a contração muscular. O filamento de actina F não mais é atraído pelas pontes cruzadas do filamento de miosina e retorna à sua posição de repouso. Os discos Z se afastam dos filamentos de miosina. Os filamentos de actina oriundos de dois discos Z sucessivos não se sobrepõem. O sarcômero está alongado. É por isso que “músculo relaxado” e “músculo alongado” são expressões sinônimas.
Veja nesta animação os processos de contração e relaxamento muscular e o respectivo encurtamento e alongamento do sarcômero.
Referências
[1] Guyton, A. C. & Hall, J. E. (1996). Contraction of skeletal muscle. In: Textbook of medical physiology (pp. 73-85). 9th ed. Philadelphia: W. B. Saunders Co.
[2] Guyton, A. C. & Hall, J. E. (1996). Excitation of skeletal muscle: A. Neuromuscular transmission and B. Excitation-contraction coupling. In: Textbook of medical physiology (pp. 87-93). 9th ed. Philadelphia: W. B. Saunders Co.